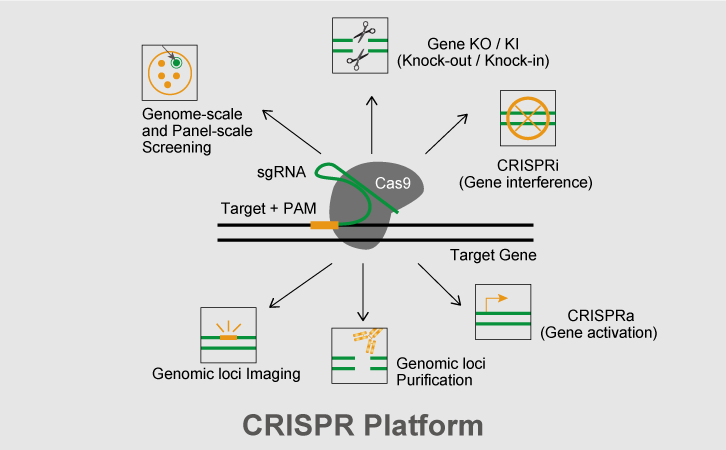
一、CRISPR-Cas技术是什么?
CRISPR/Cas系统是一种原核生物的免疫系统,用来抵抗外源遗传物质的入侵,比如噬菌体病毒和外源质粒。同时,它为细菌提供了获得性免疫:这与哺乳动物的二次免疫类似,当细菌遭受病毒或者外源质粒入侵时,会产生相应的“记忆”,从而可以抵抗它们的再次入侵。CRISPR/Cas系统可以识别出外源DNA,并将它们切断,沉默外源基因的表达。这与真核生物中RNA干扰(RNAi) 的原理是相似的。正是由于这种精确的靶向功能, CRISPR/Cas系统被开发成一种高效的基因编辑工具。在自然界中,CRISPR/Cas系统拥有多种类别,其中CRISPR/Cas9系统是研究最深入,应用最成熟的一种类别。
CRISPR/Cas9是继锌指核酸内切酶(ZFN)”、“类转录激活因子效应物核酸酶(TALEN)”之后出现的第三代“基因组定点编辑技术”。凭借着成本低廉,操作方便,效率高等优点,CRISPR/Cas9迅速风靡全球的实验室,成为了生物科研的有力帮手。
二、CRISPR-Cas9技术原理
CRISPR由一系列短的高度保守的正向重复序列(repeat)与长度相似的间隔序列(spacer)间隔排列组成。Cas基因是一类基因家族,编码的蛋白质具有与核酸结合的功能以及与核酸酶、聚合酶、解旋酶等结合的活性。根据Cas 基因的不同,将CRISPR-Cas9系统分为Ⅰ-Ⅲ 3种类型。在Ⅰ型 与Ⅲ型CRISPR-Cas9系统中,pre-crRNA 初级转录本被CRISPR相关RNA 酶切割成重复序列,释放小的成熟crRNA。成熟crRNA再与相关蛋白质结合形成RNA-蛋白质复合体指导内切核酸酶对外源DNA 序列的识别与降解。Ⅱ型CRISPR-Cas9系统是目前最常用于人工基因组编辑的CRISPR-Cas9系统。根据Cas蛋白的类型不同分为3个亚类:Ⅱ-A型含有Cas1、Cas2、Cas9 和Csn2蛋白质;Ⅱ-B型含有Cas1、Cas2、Cas4 和Csx12 样Cas9 4种蛋白质;Ⅱ-C型则有Cas1、Cas2 及Cas93种蛋白质。其中,Ⅱ 型CRISPR-Cas9 系统最早在改造后用于小鼠和灵长类基因组编辑,是目前研究最为充分的系统。它只需要单独的Cas9蛋白即可在gRNA(guide RNA)的引导下完成对DNA的定点切割。Cas9 蛋白行使功能需CRISPR转录而来的crRNA 与反式激活的及与CRISPR重复区互补的tracrRNA(trans-activiting crRNA,tracrRNA)形成的复合物参与。
为了操作简便,研究者将crRNA和tracrRNA 融合进同一条单链中,设计出单链引导RNA(single guide RNA,sgRNA)。在sgRNA的指导下,Cas9定位于特定DNA序列上,进行DNA双链切割,实现基因组的定向编辑。对靶序列有效的切割还需靶序列相邻的原型间隔序列毗邻基序,即PAM(protospacer-associated motif)的参与。PAM提供两个冗余的检查点,确保Cas9不会错误地破坏它自身的基因组DNA。CRISPR-Cas9基因组编辑技术的基本原理为将tracrRNA:crRNA设计为sgRNA,sgRNA包含位于5′端的靶DNA的互补序列,以及位于3′端的tracrRNA:crRNA的类似序列,crRNA 或sgRNA包含一个20nt指导序列可以直接匹配的靶位点,利用靶DNA的互补序列来定位需编辑的位点,利用tracrRNA:crRNA的类似序列与Cas9结合,实现目标基因定向基因组改造。
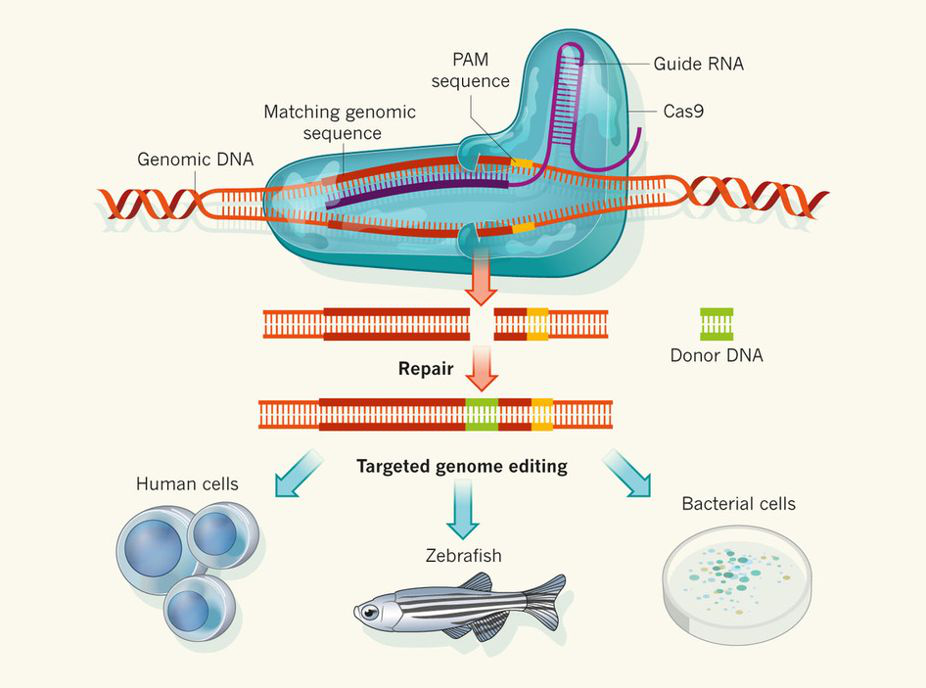
图1. CRISPR-Cas9基因组编辑技术的基本原理
三、CRISPR-Cas9应用
四、CRISPR-Cas9技术优势
1. 效率高:可精确编辑基因组,编辑效率高;
2. 周期短:构建和使用极为方便,极大降低了实验难度,缩短实验周期;
3. 广谱性:无基因、细胞及物种限制;
4. 多重编辑能力:可实现多个靶位点同时进行基因打靶;
5. 功能丰富:可实现敲除、插入、抑制、激活等多种目的基因.
五、CRISPR-Cas9基因编辑服务步骤

六、服务项目周期
|
编号 |
项目内容 |
周期(周) 注:周期为工作日 |
|
1 |
sgRNA的设计与构建 (设计8条sgRNA序列) |
1 |
|
2 |
sgRNA的筛选 |
2 |
|
3 |
载体构建 注:sgRNA串联几个待定,需要等筛选结果 |
3 |
|
4 |
转染目标细胞系,qPCR方法检测载体活性 |
1 |
|
5 |
病毒包装 |
3 |
|
交付内容:一个病毒和两个筛选报告 |
合计:10 |
|
概述
CRISPR/Cas9系统是一种由RNA引导Cas9蛋白对靶基因进行修饰的技术。将Cas9中切割域突变,就会使Cas9蛋白失去对DNA的切割活性,但不影响其与DNA的结合能力,这种失去DNA切割活性的Cas9蛋白被命名为 Dead Cas9(dCas9) 。利用gRNA介导dCas9能够精确识别靶基因的特点,将dCas9蛋白与具有转录激活功能的蛋白结构域融合,可构建具有转录激活活性的系统,简称CRISPRa。
与传统转基因相比,CRISPRa系统是通过激活细胞内源基因表达来提高目标基因的表达量,它不需要转入外源DNA,降低了由于转基因造成的基因组不可逆转突变的风险。另外结合gRNA文库,可同时激活多个基因的转录与表达。此前Gain-Of-Function筛选主要是通过cDNA文库实现,但由于部分cDNA克隆难度较大致使cDNA文库覆盖率不完全;同时cDNA文库并不能涵盖每个基因的所有转录本;基因的表达也会受到细胞内部元件的调控。利用dCas9-VP64-gRNA系统进行的高通量筛选可在同一个启动子上设计多个gRNA来提高基因的转录活性,基因转录本也会更为全面。已有研究表明,利用CRISPR/Cas9系统选择性的上调基因表达,可以用来诱导干细胞的分化或重编程、刺激组织再生、补偿遗传缺陷、激活已经失活的抑癌基因、进行基因功能筛选以及合成基因回路。
技术原理
CRISPR/Cas9系统转录激活原理:dCas9与转录活化域VP64/VPR融合,表达的融合蛋白在gRNA介导下结合到启动子区,并通过VP64/VPR激活区域与PolII结合,激活基因的转录。
解决方案
枢密科技可实现单个或多个基因的转录激活,也可以通过gRNA文库,实现全基因组的转录激活调控,用于基因功能的研究及靶基因的筛选。
服务流程

实验方案及报价
方案一:Crispr/dSaCas9转录激活系统-AAV
编号
项目内容
操作方法
周期(周)
1
sasgRNA的设计与构建
1
设计8条sasgRNA序列,位置ATG上游0-400bp
2
sasgRNA的筛选
2
3
转录激活载体构建
3
注:sgRNA串联几个待定,需要等筛选结果
4
qPCR方法转录激活验证
质粒转染,收细胞,内参GAPDH
1
5
病毒包装
病毒包装,纯化,滴度检测
3
合计 注:周期为工作日
10
交付内容:一个病毒和两个筛选报告
价格可联系销售人员咨询,欢迎前来询价。
方案二:Crispr/dSaCas9转录激活系统-Lentivirus
编号
项目内容
操作方法
周期(周)
1
sasgRNA的设计与构建
LV-U6-sasgRNA-CMV-SV40 NLS-saCas9-NLS-Flag-P2A-Puro-T2A-EGFP-WPRE
1
设计8条sasgRNA序列,位置ATG上游0-400bp
2
sasgRNA的筛选
2
3
转录激活载体构建
3
注:sgRNA串联几个待定,需要等筛选结果
4
qPCR方法转录激活验证
质粒转染,收细胞,内参GAPDH
1
5
病毒包装
病毒包装,纯化,滴度检测
3
合计 注:周期为工作日
10
交付内容:一个病毒和两个筛选报告
价格可联系销售人员咨询,欢迎前来询价。
注意:方案一中AAV(腺相关病毒载体)的载量为4.7kb,因此质粒中转录激活结构域选择片段大小为150bp的VP64;方案二中LV(慢病毒载体)的载量为6kb,因此质粒中转录激活结构域选择片段大小为1569bp的VPR(VP64, p65, and Rta );但是相关文献显示VP64对蛋白过表达的效果不佳,因此可按照需求选择其中一种病毒载体进行后期实验操作。
1. Konermann, S., Lotfy, P., Brideau, N.J., Oki, J., Shokhirev, M.N., and Hsu, P.D. (2018). Transcriptome engineering with RNA-targeting type VI-D CRISPR effectors. Cell 173, 665-676 e614.
2. Yan, W.X., Chong, S., Zhang, H., Makarova, K.S., Koonin, E.V., Cheng, D.R., and Scott, D.A. (2018). Cas13d is a compact RNA-targeting type VI CRISPR effector positively modulated by a WYL-domain-containing accessory protein. Molecular cell 70, 327-339 e325.
信息订阅
我们将及时向您推送最新产品资讯

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK