2025-05-12 阅读量:57
简介
细胞凋亡(Apoptosis),也称为细胞程序性死亡,是由基因控制的细胞自主的、有序的死亡,它在神经系统的发育、稳态维持和疾病发生中扮演着核心角色。在神经科学研究中,选择性清除特定脑区细胞是解析神经环路功能、模拟神经退行性疾病或研究细胞-行为关系的核心手段之一。传统的物理或化学损伤方法(如机械损伤、兴奋性毒素注射)存在靶向特异性不足、效率低等问题,且可能伴随炎症反应和非目标细胞损伤。相比之下,基于病毒载体的靶向细胞诱导凋亡工具(如taCasp3-TEVp、DTA、DTR)可通过特定启动子或Cre/loxP等条件性表达系统,实现细胞类型特异性、时空可控性且低炎症反应的精准细胞消融。
基本原理
病毒载体是基因递送领域的强大工具,能够将特定基因或调控元件精准导入目标细胞。其靶向性和可控性主要通过以下几方面实现:
•不同血清型赋予载体特定的细胞亲和力,使其能够靶向特定细胞类型;
•启动子的选择决定了外源基因在靶细胞中的表达水平、时间动态和细胞特异性;
•不同的调控系统(Cre-loxP、Flp-FRT、CreERT2、Tet-on/off等)通过时空;
特异性和诱导性控制,进一步确保了基因表达的精确性。通过这些设计结合不同的注射方式,病毒载体可以将促凋亡基因或元件精准导入目标细胞,激活细胞内的凋亡信号通路,诱导细胞凋亡。重要的是,这种靶向性设计确保凋亡作用仅限于目标脑区细胞,不影响其他区域的正常细胞功能。接下来将详细介绍几种关键的凋亡元件,它们是实现这一精准调控的核心。
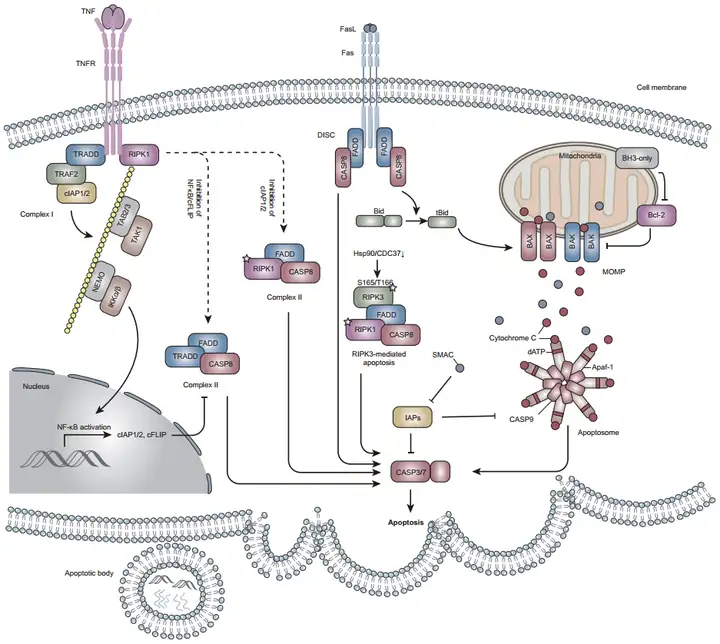
1.taCasp3-TEVp
taCasp3-TEVp是一种基于蛋白切割激活原理的基因编码型细胞凋亡诱导工具,其设计原理是在Pro-caspase-3(半胱天冬酶-3(Caspase-3)的前体)的活化切割位点插入烟草蚀纹病毒蛋白酶(TEVp)的特异性识别序列,构建成TEVp-activatable caspase-3(taCasp3)。在天然凋亡通路中,Caspase-3是细胞凋亡执行阶段的关键蛋白酶,通常以前体形式存在,被上游Caspase切割后激活。而工程化的taCasp3将该活化位点改造为TEVp特异性切割序列,使其仅能被外源表达的TEVp激活,而不能被内源性caspase级联反应激活。活化后的taCasp3保留了野生型caspase-3的底物特异性,能够高效切割多聚ADP-核糖聚合酶(PARP)等多种凋亡相关底物,破坏细胞的结构与功能,最终导致细胞凋亡。在没有TEVp存在的情况下,taCasp3保持非活性状态,不会引发细胞凋亡。
AAV-taCasp3-TEVp介导的NAcS(伏隔核壳区)神经元凋亡(Yu, Yu-Mei et al., Current biology, 2025.)
2.DTA
DTA即白喉毒素A亚基(Diphtheria toxin A subunit),是一种来源于白喉杆菌(Corynebacterium diphtheriae)白喉毒素(Diphtheria toxin,DT)的催化亚基。当DTA进入细胞后,它会特异性识别细胞内的延伸因子2(EF-2),并对其进行不可逆的ADP-核糖基化修饰。这种修饰会使EF-2失去活性,导致翻译延伸受阻,进而抑制细胞内的蛋白质合成。蛋白质合成的受阻会引发一系列细胞应激反应,最终激活细胞内的凋亡信号通路,导致细胞发生凋亡。这种机制使得DTA成为一种非常强大的细胞杀伤工具,能够在短时间内高效地清除目标细胞。
AAV-DTA介导的IC(岛叶皮层)、BNST(终纹床核)及CeA(中央杏仁核)神经元凋亡(Sun, Yan-Hui et al., Advanced science (Weinheim, Baden-Wurttemberg, Germany), 2024.)
3.DTR
DTR(白喉毒素受体)是一种跨膜蛋白,由多个结构域组成。其胞外结构域能够特异性地识别并结合白喉毒素,胞内结构域则在信号转导过程中发挥关键作用。通过病毒载体将DTR基因导入靶细胞后,细胞膜表面会稳定表达该受体蛋白,其本身并不具有直接毒性。当外源性DT存在时,其B亚基(DTB)会特异性识别并结合DTR胞外区的结构域,形成DT-DTR复合物。随后,该复合物通过内吞作用进入细胞,在内体酸化条件下发生构象变化,促使DT的A亚基(DTA)释放,并转运至细胞质中。如前文所述,DTA会对EF-2进行ADP-核糖基化修饰,抑制蛋白质合成,进而诱导细胞凋亡。该系统的核心优势在于其时空可控性——通过精确调控DT的给药时间和剂量,能够实现特定细胞群体清除范围(局部或全身)和强度(部分或完全清除)的灵活控制。
部分客户案例
案例1
客户文章(IF=8.1):
Yu YM, Xia SH, Xu Z, Zhao WN, Song L, Pan X, Zhong CC, Wang D, Gao YH, Yang JX, Wu P, Zhang H, An S, Cao JL, Ding HL. An accumbal microcircuit for the transition from acute to chronic pain. Curr Biol. 2025 Apr 21;35(8):1730-1749.e5. doi: 10.1016/j.cub.2025.02.055. Epub 2025 Mar 19. PMID: 40112811.
使用我司病毒:
AAV2/9-hSyn-taCasp3-T2A-TEVp-WPRE-hGH pA
AAV2/9-D1-DIO-taCasp3-TEVp-P2A-mCherry-WPREs
AAV2/9-D2-DIO-taCasp3-TEVp-P2A-mCherry-WPREs
AAV2/9-D1-DIO-taCasp3-P2A-mCherry-WPREs
AAV2/9-D2-DIO-taCasp3-P2A-mCherry-WPREs
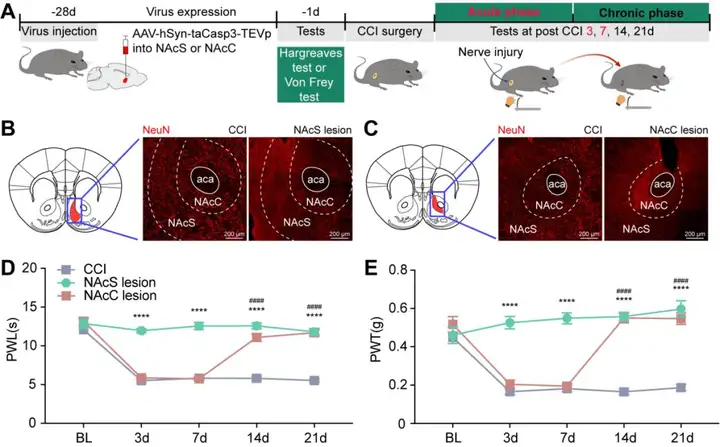
为了深入探究NAcS(伏隔核壳区)和NAcC(伏隔核核心区)在疼痛慢性化中的作用,研究人员在CCI(坐骨神经慢性压迫损伤)手术前对NAcS或NAcC神经元进行了凋亡介导的消融处理,并在CCI小鼠的不同时间点对其疼痛感觉进行了测量。具体而言,研究人员在CCI手术前28天将AAV2/9-hSyn-taCasp3-TEVp或其对照载体注射到NAcS或NAcC中(图1 A)。通过NAcS或NAcC神经元数量的显著减少验证了这种损伤处理的有效性(图1 B,C)。研究结果显示,NAcS神经元的消融不仅能在CCI急性期发挥镇痛作用,还能防止疼痛慢性化(急性损伤向慢性疼痛过渡),而NAcC神经元的消融仅在CCI慢性期发挥镇痛作用,在CCI急性期则未观察到明显效果(图1 D,E)。
图1. NAcS(而非NAcC)神经元的消融可防止疼痛慢性化
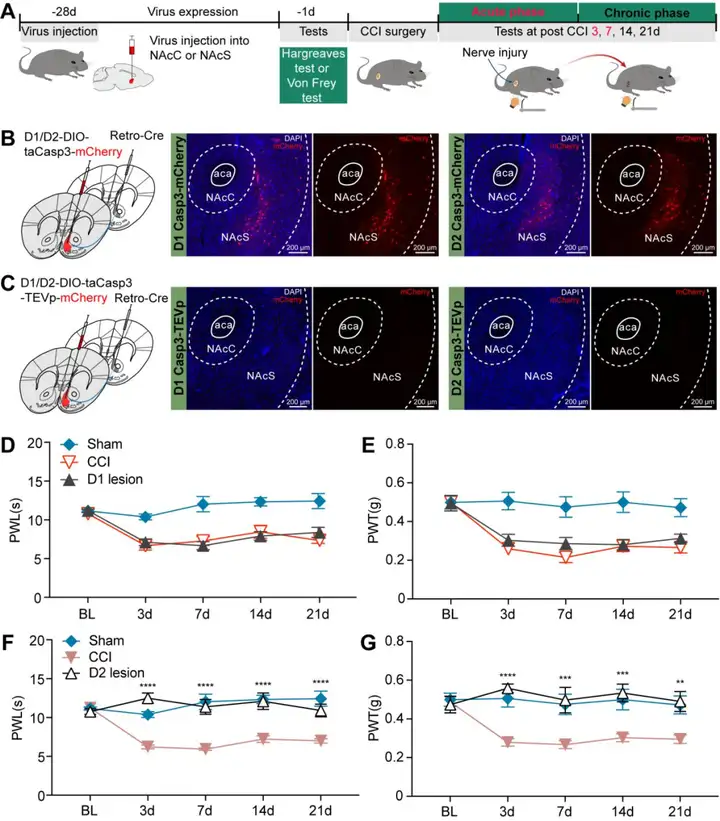
为了探究投射到NAcC的NAcS D1(表达多巴胺受体1)和D2(表达多巴胺受体2)神经元(命名为NAcSD1-NAcC或NAcSD2-NAcC神经元)在疼痛慢性化中的作用,研究人员在CCI手术前28天对NAcSD1-NAcC或NAcSD2-NAcC神经元进行了凋亡介导的消融处理,并在CCI小鼠术后第3、7、14和21天检测疼痛阈值(图2 A)。具体操作如下:将逆行病毒AAV2/R-hSyn-Cre注射到NAcC,同时将D1/D2特异性启动子启动的Cre依赖性的凋亡病毒AAV2/9-D1/D2-DIO-taCasp3-TEVP-mCherry注射到NAcS(图2 C),借助DIO系统使taCasp3仅在NAcSD1-NAcC或NAcSD2-NAcC神经元中表达,实现特异性、选择性的消融。对照组则注射无TEVp的AAV2/9-D1/D2-DIO-taCasp3-mCherry病毒(图2 B)。结果显示,与CCI对照组相比,NAcSD2-NAcC神经元的消融显著提高了CCI急性期和慢性期的疼痛阈值,表明其可预防疼痛慢性化(图2 F,G);而NAcSD1-NAcC神经元的消融则无此效果(图2 D,E)。
案例2
客户文章(IF=11.7):
Cao P, Liu Y, Ni Z, Zhang M, Wei HR, Liu A, Guo JR, Yang Y, Xu Z, Guo Y, Zhang Z, Tao W, Wang L. Rescue-like behavior in a bystander mouse toward anesthetized conspecifics promotes arousal via a tongue-brain connection. Sci Adv. 2025 Jan 24;11(4):eadq3874. doi: 10.1126/sciadv.adq3874. Epub 2025 Jan 22. PMID: 39841840; PMCID: PMC11753405.
使用我司病毒:
rAAV2/9-nEF1a-fDIO-taCasp3-TEVp-WPRE-hGH pA
rAAV2/Retro-hSyn-FLp-WPRE-hGH pA
研究人员在小鼠的舌头上注射了逆行病毒AAV2/Retro-hSyn-Flp,并在MTN(中脑三叉神经核)中注射了Flp依赖的凋亡病毒AAV-fDIO-taCasp3,从而特异性凋亡支配舌的MTN神经元(图3 G)。四周后,免疫荧光染色显示MTNGlu">MTNGlu神经元[利用抗谷氨酸抗体标记MTN谷氨酸能神经元]被选择性消融,而LC(蓝斑核)中的谷氨酸能神经元保持完整(图3 H,I)。行为学结果显示,缺乏 MTNGlu">MTNGlu 神经元的小鼠对麻醉苏醒期间舌夹刺激后的翻正反射恢复(RORR)时间显著增加,而翻正反射消失(LORR)时间无显著差异(图3 R)。
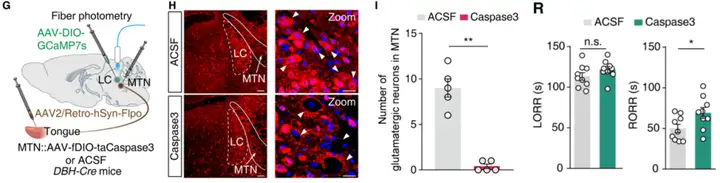
图3. 投射舌的MTNGlu神经元消融对麻醉小鼠唤醒效应的影响
案例3
客户文章(IF=14.3):
Sun YH, Hu BW, Tan LH, Lin L, Cao SX, Wu TX, Wang H, Yu B, Wang Q, Lian H, Chen J, Li XM. Posterior Basolateral Amygdala is a Critical Amygdaloid Area for Temporal Lobe Epilepsy. Adv Sci (Weinh). 2024 Dec;11(48):e2407525. doi: 10.1002/advs.202407525. Epub 2024 Oct 30. PMID: 39476381; PMCID: PMC11672268.
使用我司病毒:
AAV2/9-EF1a-DIO-DTA
AAV2/9-EF1a-fDIO-DTA
AAV2/9-CaMKIIa-Cre
AAV2/9-CaMKIIa-Flp
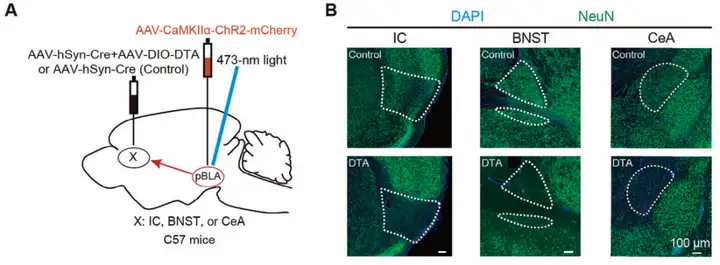
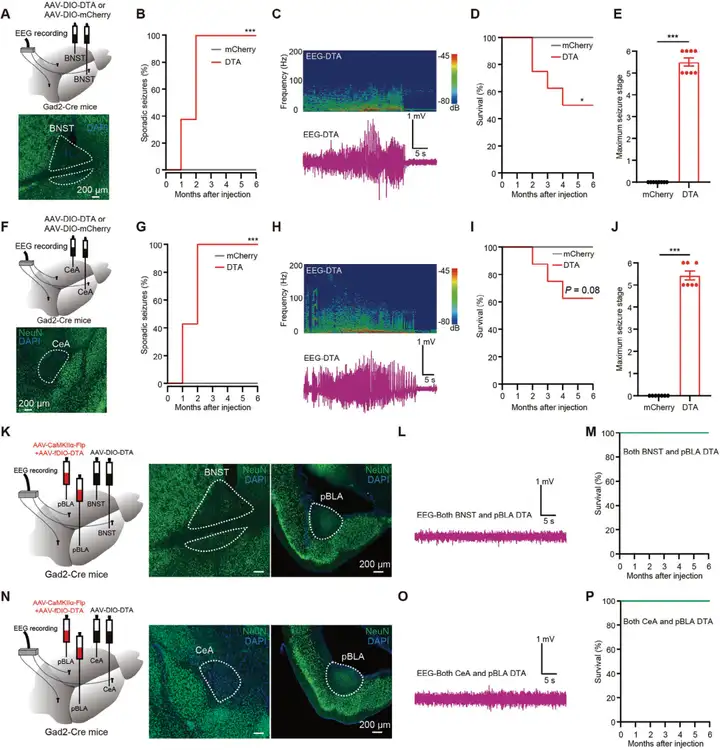
为研究沉默下游IC(岛叶皮层)神经元是否能缓解由pBLA(基底外侧杏仁核后部)谷氨酸能神经元兴奋引起的癫痫发作。研究人员在C57BL/6J小鼠的双侧IC注射AAV-DIO-DTA和AAV-hSyn-Cre(对照组仅注射AAV-hSyn-Cre)触发其凋亡,同时在pBLA区域注射AAV-CaMKIIa-ChR2-mCherry,并在双侧pBLA上方植入光纤(图4 A)。注射后3周,通过NeuN(神经元核标记蛋白)免疫荧光染色确认IC神经元成功凋亡(图4 B)。EEG记录表明,IC神经元的凋亡显著缓解了由pBLA谷氨酸能神经元激活引起的癫痫样放电(图4 C),显著降低了癫痫发作期五种不同频段脑电波的功率(图4 D),并改善了动物的癫痫行为表型(图4 E,采用改良Racine量表评估癫痫发作严重程度:1级为面部抽动,6级为致死性惊厥)。此外,研究人员还通过同样方法诱导BNST(终纹床核)或CeA(中央杏仁核)神经元凋亡来研究其对pBLA谷氨酸能神经元激活引发的癫痫发作的影响(图4 A,B)。结果表明,BNST或CeA神经元的凋亡并未缓解癫痫样放电或降低癫痫发作的严重程度(图4 F-K)。这些实验结果证实了IC神经元在传播pBLA诱导的癫痫活动中发挥关键作用。
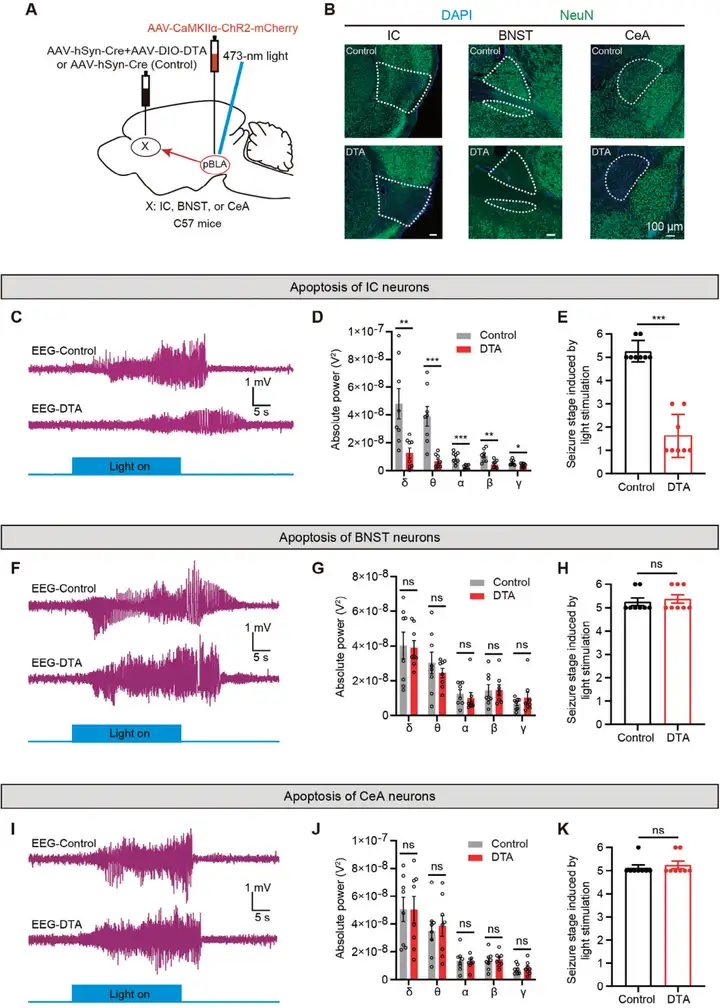
图4. IC(而不是BNST或CeA)神经元的凋亡显著缓解了pBLA谷氨酸能神经元激活诱导的癫痫发作
为了研究BNSTGABA⁺和CeAGABA⁺神经元对pBLA谷氨酸能神经元的反馈抑制在癫痫发作中的作用,研究人员在Gad2-Cre小鼠(GABA能神经元中特异性表达Cre酶)的BNST或CeA区域注射Cre依赖的AAV-DIO-DTA,诱导其GABA能神经元凋亡(图5 A,F)。结果显示:DTA注射后1个月,约40%的小鼠出现偶发性癫痫样放电和癫痫发作;2个月后,所有小鼠均出现这些症状(图5 B,C,G,H)。4个月后,因癫痫发作导致的死亡率约为40%(图5 D,E,I,J)。然而,当同时在pBLA注射AAV2/9-EF1a-fDIO-DTA和AAV2/9-CaMKIIa-Flp,消融BNSTGABA⁺神经元和pBLA谷氨酸能神经元,或CeAGABA⁺神经元和pBLA谷氨酸能神经元时(图5 K,N),未观察到癫痫样放电、癫痫发作或死亡(图5 L,M,O,P)。即BNST和CeA中的GABA能神经元可能通过反馈抑制限制pBLA谷氨酸能神经元的过度活动,从而在生理条件下抑制癫痫样放电和癫痫发作。
图5. BNST或CeA中GABA能神经元的消融导致偶发性癫痫发作,可能是由于对pBLA谷氨酸能神经元的反馈抑制减少所致
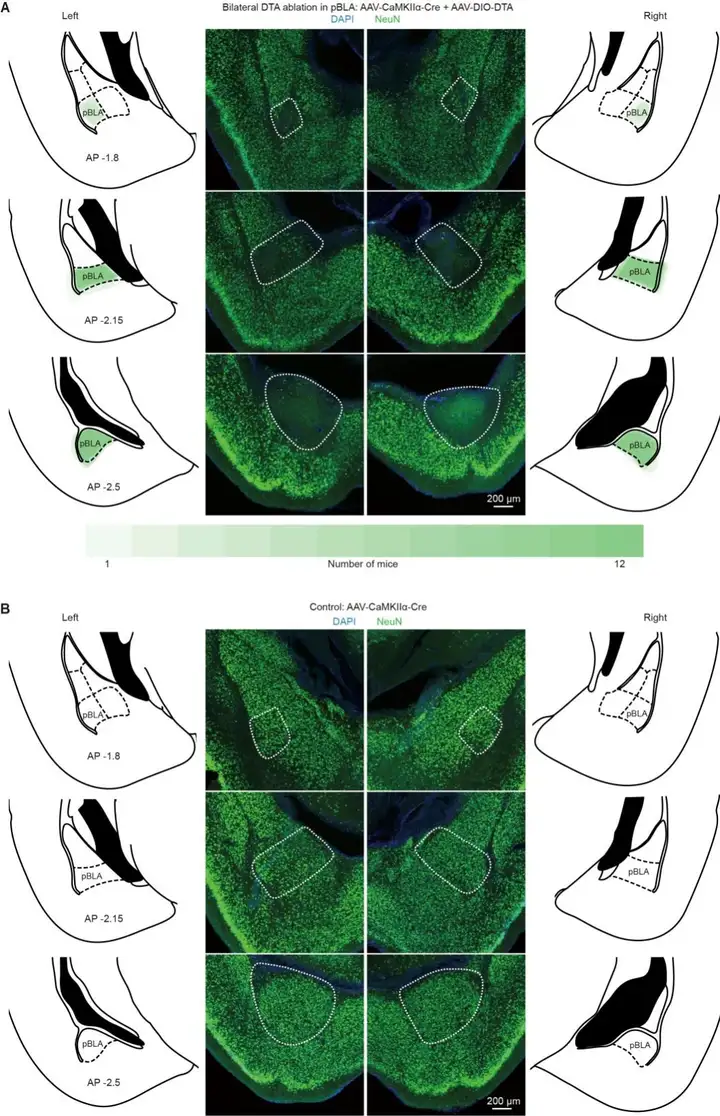
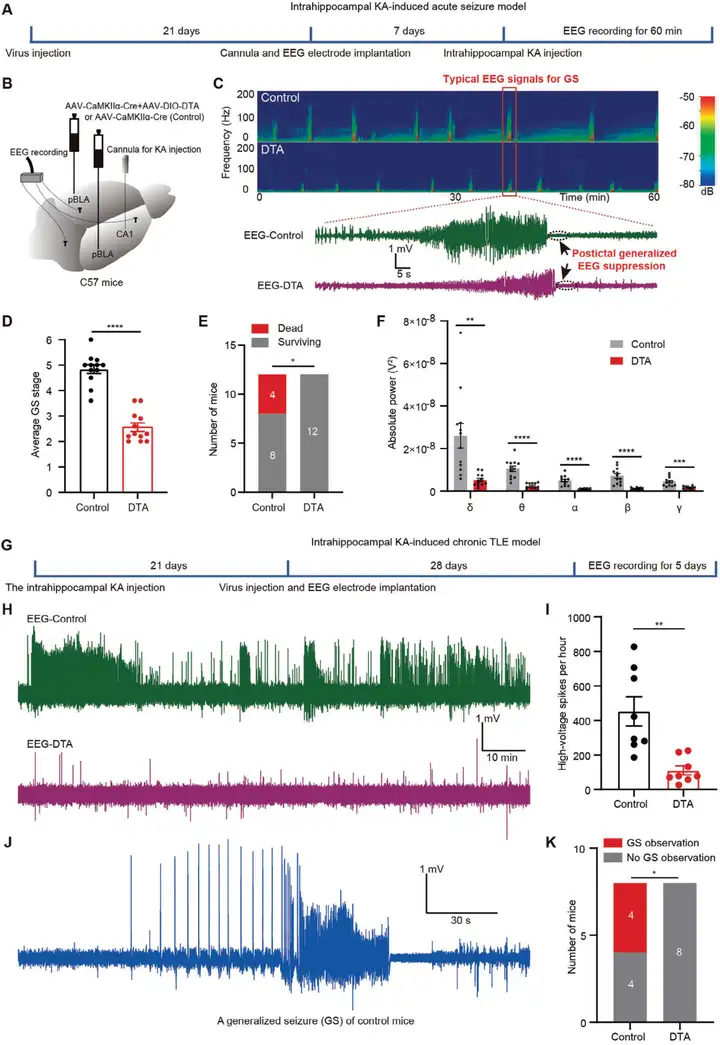
为了探究消融pBLA谷氨酸能神经元是否能缓解KA(海人酸)诱导的急性癫痫发作(图7 A),研究人员在小鼠双侧pBLA区域注射了AAV-DIO-DTA和AAV-CaMKIIa-Cre(图7 B)。4周后,双侧注射DTA的小鼠pBLA区域NeuN阳性细胞减少,而仅注射AAV-CaMKIIa-Cre的对照组小鼠未出现此现象(图6)。随后,通过植入导管将KA注入海马CA1区,持续监测小鼠60分钟以评估癫痫发作行为和EEG信号(图7 A)。全身性癫痫发作(GSs)通过EEG特征模式识别,表现为短暂高振幅信号后跟随平坦信号(图7 C)。结果显示,pBLA谷氨酸能神经元的消融显著降低了EEG功率谱和GSs严重程度(图7 C,D),减少了急性癫痫发作期的死亡率(图7 E),并降低了EEG五种脑电波的功率(图7 F)。这些结果表明,pBLA谷氨酸能神经元的消融可有效抑制KA诱导的急性癫痫发作,降低严重癫痫发作相关死亡风险。
接下来,研究人员探究了pBLA谷氨酸能神经元的消融是否能抑制KA诱导的慢性复发性自发性癫痫发作的症状。向海马注入KA,双侧注射AAV-DIO-DTA和AAV-CaMKIIa-Cre以消融pBLA谷氨酸能神经元,并在头骨表面放置电极记录EEG。在KA注射后第七周,连续5天、每天8小时监测小鼠的自发性高电压棘波(>0.5 mV)(图7 G)。结果显示,pBLA谷氨酸能神经元消融显著减少了自发性高电压棘波的数量(图7 H,I),且未观察到小鼠全身性癫痫发作(图7 J,K)。这些发现表明,pBLA谷氨酸能神经元消融在KA诱导的慢性颞叶癫痫(TLE)模型中有效缓解了癫痫发作。
图6. 双侧DTA消融pBLA谷氨酸能神经元
图7. pBLA谷氨酸能神经元的消融显著缓解海马内KA诱导的TLE模型中的急性和慢性癫痫发作
案例4
客户文章(IF=18.688):
Xie Z, Feng J, Hibberd TJ, Chen BN, Zhao Y, Zang K, Hu X, Yang X, Chen L, Brookes SJ, Spencer NJ, Hu H. Piezo2 channels expressed by colon-innervating TRPV1-lineage neurons mediate visceral mechanical hypersensitivity. Neuron. 2023 Feb 15;111(4):526-538.e4. doi: 10.1016/j.neuron.2022.11.015. Epub 2022 Dec 22. PMID: 36563677; PMCID: PMC9957938.
使用我司病毒:
rAAV2/Retro-EF1a-DIO-DTA-WPRE-hGH-pA
rAAV2/Retro-EF1a-DIO-EGFP-WPRE-hGH-pA
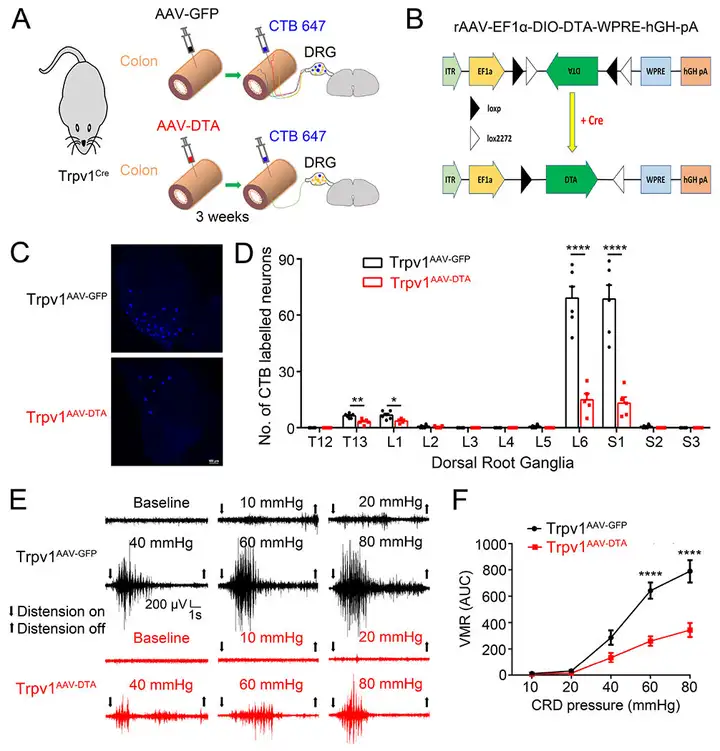
为了选择性地消融支配结肠的TRPV1(瞬时受体电位香草素亚型1通道)表达的(TRPV1+)感觉伤害性感受器,研究人员将编码DTA的rAAV载体(rAAV2/Retro-EF1a-DIO-DTA-WPRE-hGH-pA)注射到Trpv1-Cre小鼠远端结肠区域(记为Trpv1AAV-DTA)(图8 A,B)。对照组使用rAAV2/Retro-EF1a-DIO-EGFP-WPRE-hGH-pA病毒(记为Trpv1AAV-GFP)。为了评估支配结肠的TRPV1+ DRG(背根神经节)神经元的消融程度,研究人员在注射病毒3周后,将逆行示踪剂CTB647注射到相同部位的结肠壁中。结果显示,与Trpv1AAV-GFP小鼠相比,Trpv1AAV-DTA小鼠中CTB647标记的神经元数量显著减少(图8 C,D),表明通过结肠内注射DTA病毒可有效消融支配结肠的TRPV1+ DRG神经元。
在病毒注射3周后,研究人员通过记录腹部肌肉的VMR(内脏运动反应),进一步评估了小鼠对不同等级CRD(结直肠扩张)压力的内脏疼痛反应。结果显示,与Trpv1AAV-GFP小鼠相比,Trpv1AAV-DTA小鼠对有害的CRD压力(60和80 mmHg)产生的VMR显著降低(图8 E,F)。相比之下,病毒介导的支配结肠的TRPV1+ DRG神经元的消融并未影响急性躯体机械痛与热痛觉(图8 G,H)。这些结果有力地证明了支配结肠的TRPV1+神经元是小鼠结肠中机械传导和伤害性感受的关键组成部分。
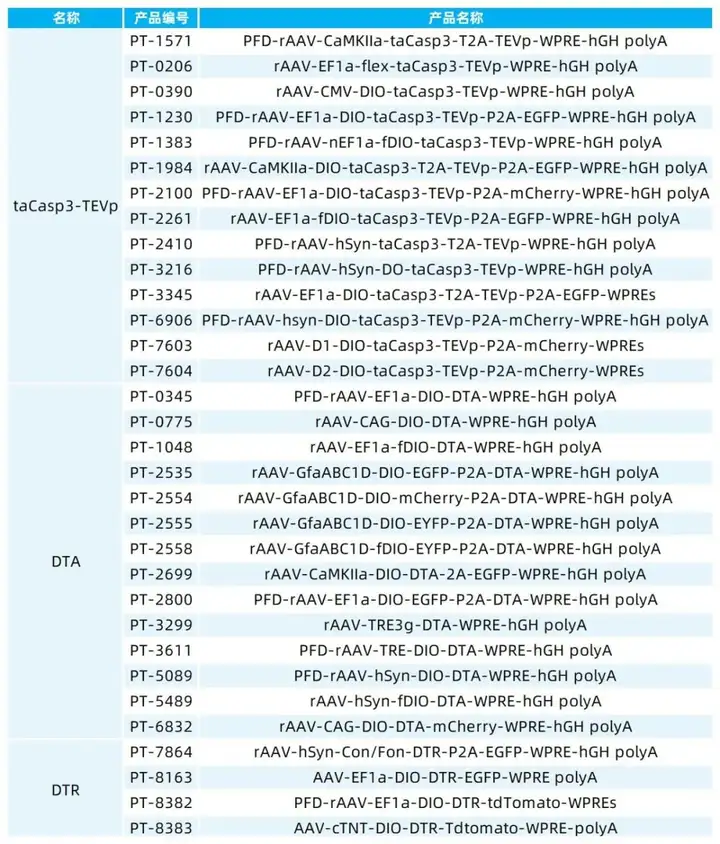
我司提供多种诱导凋亡病毒,部分产品列表如下:

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK