2024-04-24 阅读量:80
焦虑症是全球范围内高发的精神疾病之一[1-2]。目前存在多种神经病理学机制解释焦虑症的产生,包括单胺神经递质[3]、神经环路改变[4]和神经胶质细胞[5]等。除此之外,外周因子在调节焦虑中的作用同样关键。然而,我们目前对于外周-中枢调控通路在焦虑障碍中的潜在机制尚未完全理解。肝脏作为人体主要代谢中心,与多种情感障碍密切相关。除了IL-6和TNF-α等经典因子外[6],肝组织还分泌另一种细胞因子载脂蛋白2(LCN2)。在人类患者中,LCN2的升高与合并心力衰竭的抑郁症状相关[7]。但目前关于外周LCN2是否参与调控焦虑障碍尚不清楚。
2024年4月8日,暨南大学粤港澳中枢神经再生研究院张力研究员课题组在Nature Communications期刊上在线发表题为“Stress increases hepatic release of lipocalin 2 which contributes to anxiety-like behavior in mice”的论文,发现压力会增加肝脏LCN2的释放,进而导致皮层功能的异常,最终造成焦虑样行为的发生。

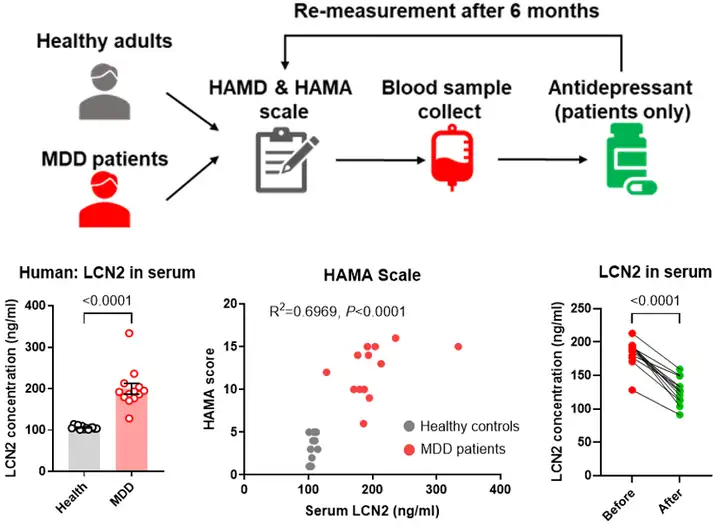
首先,作者团队招募了具有明显焦虑症状的重度抑郁症(MDD)患者,发现患者的血清LCN2水平比健康对照组明显升高,且个体LCN2浓度与HAMA焦虑量表评分呈正相关。而这些MDD患者经过治疗后,LCN2水平恢复到相对正常(图1),提示LCN2在焦虑症发生中具有潜在的作用。
图1. 血清LCN2与人类的焦虑症相关
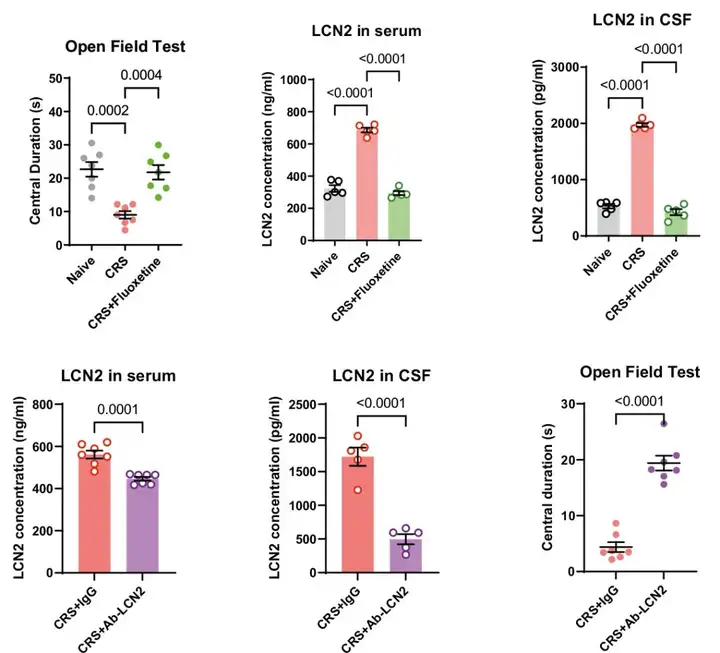
与此同时,作者采用慢性束缚压力应激(CRS)抑郁小鼠模型,并发现其血清和脑脊液LCN2水平均明显升高。而通过氟西汀药物治疗或者注射LCN2抗体,均能缓解CRS小鼠的焦虑样行为(图2)。这些结果表明外周LCN2与压力导致的小鼠焦虑样行为相关。
图2. 血清、脑脊液LCN2水平可能与小鼠焦虑样行为相关
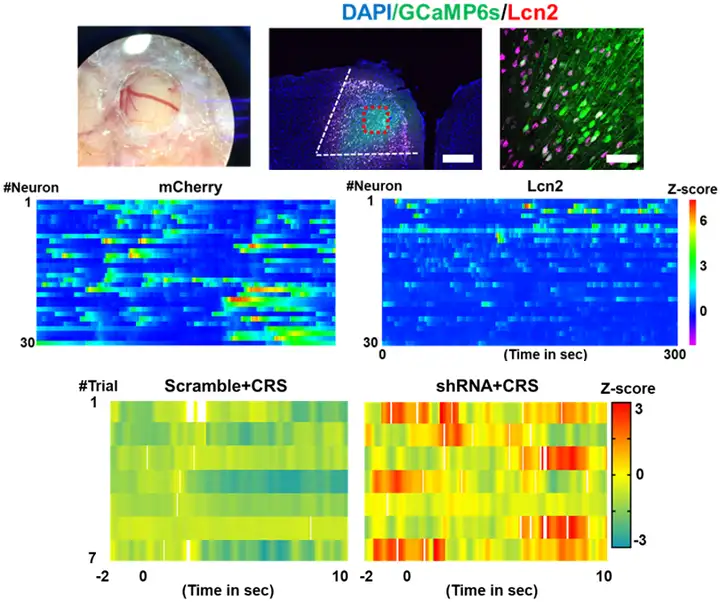
为了确定LCN2诱导焦虑样行为的机制,作者对内侧前额叶皮层(mPFC)中进行在体双光子钙成像记录。结果表明,局部的LCN2蛋白过表达显著抑制了锥体神经元的活动性。而在mPFC中敲低LCN2受体Slc22a17的表达,则有效地恢复了CRS模型中mPFC神经元活动(图3)。这些结果说明了LCN2通过特异性受体结合,影响mPFC神经元的活动。
图3. mPFC中LCN2通过受体SLC22A17影响神经元活动性
在确立LCN2改变mPFC神经网络的基础上,作者对外周LCN2的来源进行了探究。通过对不同器官定量分析发现,与正常对照组相比,只有肝组织的LCN2表达在CRS组中成倍升高。为了进一步验证上述发现,通过对CRS小鼠肝脏特异性敲低Lcn2的表达,发现血清和脑脊液中LCN2水平显著降低,而mPFC神经元活动性恢复正常,并伴随焦虑样表型的消失(图4)。这些结果表明肝脏来源LCN2在压力应激中发挥着重要作用。
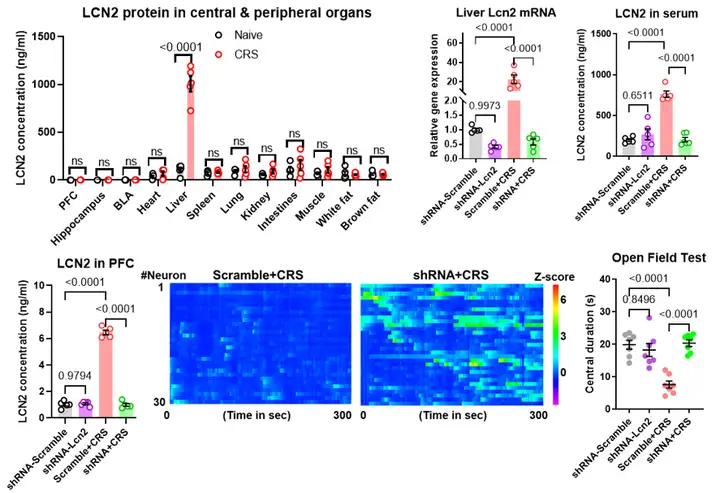
图4. 肝脏LCN2在应激下影响mPFC神经元活动性介导焦虑障碍
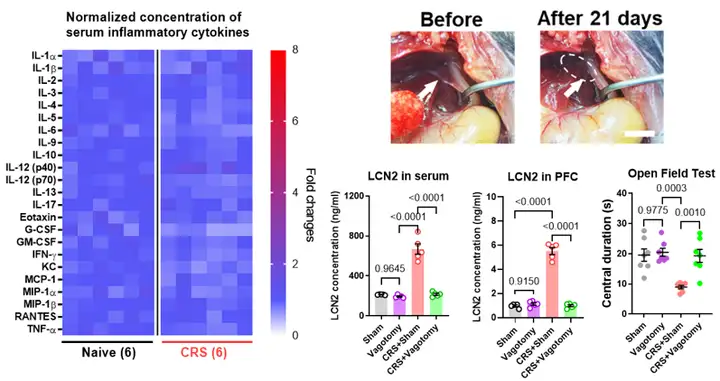
接下来,作者对压力条件下肝脏LCN2合成的调控机制进行了相关研究。作者首先发现,CRS小鼠血清中多种炎症细胞因子没有显著变化,提示可能的神经调控通路。通过膈下迷走神经切断术,发现其可以显著抑制CRS小鼠肝脏LCN2的增加,并预防焦虑样行为的产生(图5)。
图5. 迷走神经通过肝脏LCN2诱导焦虑障碍
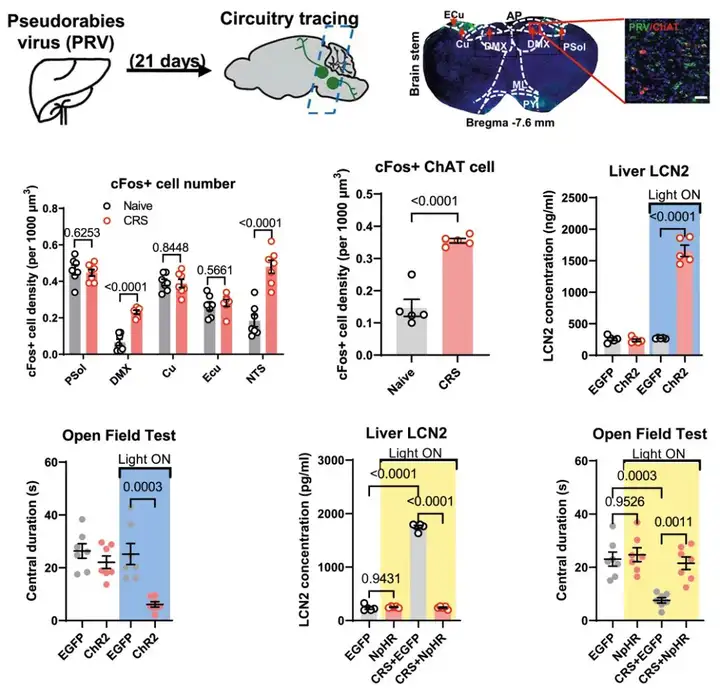
最后,为探究调控肝脏分泌LCN2的上游脑区,作者利用伪狂犬病病毒(PRV)逆行标记肝组织的上游神经元,结合cFos荧光标记,只有迷走神经背核(DMX)中胆碱能神经元(ChAT+)活性在CRS组中增加。进一步通过双病毒体系,特异性操纵DMX-肝脏下行通路,发现其影响肝脏LCN2合成,并调控小鼠的焦虑样行为(图6)。这些结果共同表明了存在一条DMX-迷走神经-肝脏通路,通过LCN2释放对焦虑障碍发挥重要作用。
图6. DMX影响迷走神经传出通路,调控肝脏LCN2水平,并诱导焦虑障碍
综上,本项研究初步揭示了一条“迷走神经-肝脏-皮层”环路,其中DMX在压力情况下通过迷走传出神经促进肝脏产生LCN2,进而抑制mPFC神经元活动,导致焦虑样行为的产生。上述结果有助于我们更好了解应激压力下的肝-脑轴通路改变,并为焦虑症的早期诊断或干预提供了分子依据。
论文工作在暨南大学粤港澳中枢神经再生研究院“运动与脑健康”实验室(负责人:苏国辉院士、张力研究员)完成。张力研究员为本文的独立通讯作者;暨南大学博士毕业生晏兰、博士生杨凤珍、硕士生王雅杰等为本论文的共同第一作者。该研究得到了科技创新2030-脑科学与类脑研究重大专项青年科学家项目、国家自然科学基金等项目的支持。
“运动与脑健康”实验室成员合照(照片提供自“运动与脑健康”实验室)
暨南大学粤港澳中枢神经再生研究院“运动与脑健康”实验室由苏国辉院士、张力研究员共同组建。实验室现有博士后1人,科研助理2人,博士生7人,硕士生13人。课题组聚焦“运动改善情感认知障碍的外周-中枢机制”这一科学问题开展工作,自2019年以来取得了一系列成果。代表性工作包括:
(1)鉴定运动改善情感障碍的外周因子,从肝脏、脂肪等组织中发现S-腺苷甲硫氨酸、凝聚素等因子,阐明其对情感障碍的改善效果(Science Advances 2023;Cell Reports 2023;Advanced Science 2022等);
(2)阐明运动改善突触结构和功能的分子机制,揭示了运动刺激外周因子通过激活脑内mTOR通路等,促进突触结构发生和功能重塑,缓解情感障碍的机理(Nature Communications 2024;Translational Psychiatry 2023;Science Advances 2019等);
(3)解析运动改善脑功能的环路机理,发现了运动后外周因子通过调控皮层、杏仁核等脑区神经环路,影响情感及社交等行为的机制(National Science Review 2023;Communications Biology 2023;Molecular Psychiatry 2021等)。课题组联系方式:zhangli@jnu.edu.cn(张力研究员)。
参考文献:
[1] Mohammadi, M. R. et al. Generalized anxiety disorder: prevalence, predictors, and comorbidity in children and adolescents. J. Anxiety Disord. 73, 102234 (2020).
[2] Bosman, R. C. et al. Prevalence and course of subthreshold anxiety disorder in the general population: A three-year follow-up study. J. Affect. Disord. 247, 105–113 (2019).
[3] Craske, M. G. & Stein, M. B. Anxiety. Lancet 388, 3048–3059 (2016).
[4] Calhoon, G. G. & Tye, K. M. Resolving the neural circuits of anxiety. Nat. Neurosci. 18, 1394–1404 (2015).
[5] Zhou, X. et al. Astrocyte, a promising target for mood disorder interventions. Front. Mol. Neurosci. 12, 136 (2019).
[6] Qin, L. et al. Systemic LPS causes chronic neuroinflammation and progressive neurodegeneration. Glia 55, 453–462 (2007).
[7] Gouweleeuw, L. et al. The role of neutrophil gelatinase associated lipocalin (NGAL) as biological constituent linking depression and cardiovascular disease. Brain Behav. Immun. 46, 23–32 (2015).
本文使用的来自枢密科技的病毒产品,列表如下:


了解产品及服务
请扫码或添加客服微信:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK