2023-10-09 阅读量:4606
一、RV示踪介绍
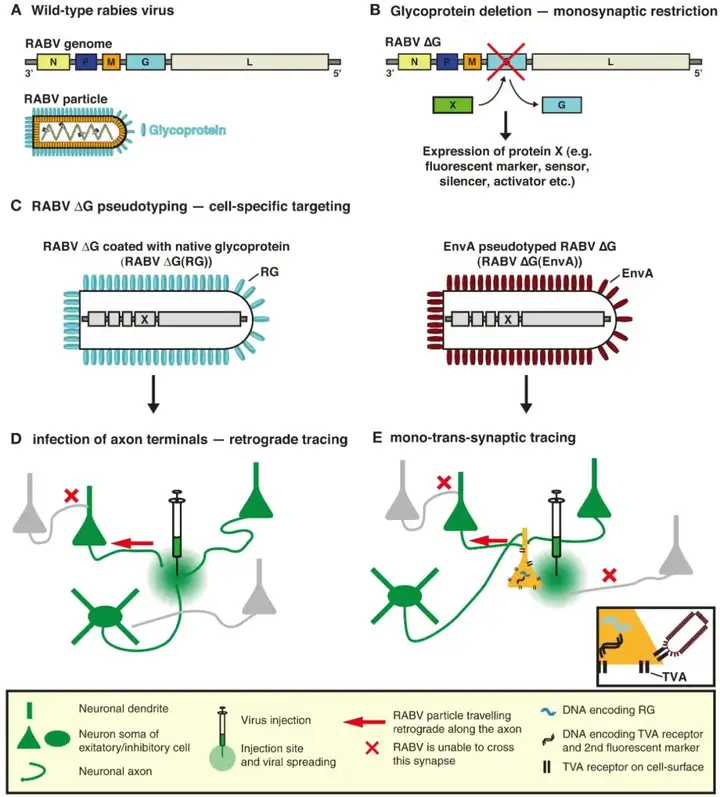
了解大脑如何处理信息需要了解其潜在神经元回路的结构,以及结构和生理功能之间的关系。研究表明,重组狂犬病毒(RABV)作为一种突触特异性跨神经元逆行示踪剂,基于糖蛋白基因缺失(△G)RABV方法的开发使追踪和功能研究特定神经元的单突触连接成为可能。这种方法可以很容易地与多种基因的表达、光遗传学、电生理学方法和行为分析结合,以推动神经环路的综合研究。
跨单突触示踪技术利用伪型重组RABV来识别靶细胞群体的直接突触前输入,这些连接是“单突触”的,因为跨突触传播仅限于初始感染细胞跨一级突触。RABV的精细特异性确保了只有突触连接的神经元被标记。为实现高特异性示踪系统,研究人员利用缺失突变的RABV(RABV-△G),缺乏RABV包膜糖蛋白(RG)的表达,RG对于RABV自然生命周期中感染性病毒颗粒的组装是必不可少的,同时对于介导病毒的跨突触传播至关重要(G蛋白缺失阻碍跨突触传播),而外源表达RG能挽救病毒的跨突触能力。
利用禽肉瘤和白血病病毒的包膜糖蛋白(EnvA),其同源受体(TVA)在哺乳动物细胞中不表达。EnvA伪型RABV-△G[RABV-△G(EnvA)]仅感染表达TVA受体的神经元。反式互补RG使RABV-△G能跨一级突触感染特定的突触前神经元。而由于这些突触前细胞中缺乏RG,病毒无法进一步扩散,从而形成跨单突触系统。将编码荧光蛋白基因插入到RABV基因组缺失G的位点以修饰RABV,能使病毒追踪的神经元(跨突触标记神经元)可视化。此外,带有天然糖蛋白外壳的RABV-△G(RG)在轴突末梢被轴突吸收,可作为逆行示踪剂通过标记投射到特定靶区的细胞来推断脑区间的连接。
图1. RABV跨单突触示踪示意图(Ginger M, et al. Front Neural Circuits. 2013.)
目前常用的RABV是疫苗株SAD-B19,它具有高滴度、热稳定性好、免疫原性低的优点。而来源于新生小鼠大脑和鼠神经母细胞瘤细胞中的CVS-N2c株,与SAD-B19相比,表现出更低的神经毒性,更轻微的神经损伤和更高效的标记效率。
二、客户文章案例——SAD株
1. 在背内侧前额叶皮层(dmPFC)注射AAV-helper和RV观察腹侧海马(vHPC)的逆行标记情况。
鉴于CCK(胆囊收缩素)dmPFC神经元在环境偶联的阿一片药物耐受(AOAT)发展中的关键作用,研究人员在CCK-CreER小鼠dmPFC中使用RV介导的逆行跨单突触追踪系统进一步表征了GluvHPC神经元和CCKdmPFC神经元之间的连接。结果显示vHPC中检测到单突触输入神经元,此外,这些神经元中71.9%显示CaMKII免疫阳性,表明CCKdmPFC神经元接收来自GluvHPC神经元的单突触投射。

图2. 逆行跨突触示踪鉴定GluvHPC→CCKdmPFC环路
(dmPFC中起始细胞共表达AAV-DIO-TVA-GFP、AAV-DIO-RVG及RV-EnvA-△G-DsRed,黄色荧光;vHPC中DsRed+神经元为上游输入神经元,红色荧光;Hou Y, Zou G, Wang X, et al. Sci Adv. 2023.)
2. 在前下丘脑核(AHN)注射AAV-helper和RV观察腹侧海马下托(vSub)的逆行标记情况。
研究人员为确定驱动AHNVgat+神经元活动及回避行为(引发焦虑场景中)的突触输入,利用狂犬病毒追踪策略,将表达TVA-GFP、RVG的AAVs混合物注射到Vgat-IRES-Cre雄性小鼠AHN中,三周后,同一位点注射RV-EnvA-△G-dsRed,结果显示,AHN中有很多GFP+/dsRed+“起始”细胞,逆行标记dsRed+细胞在上游脑区vSub观察到。
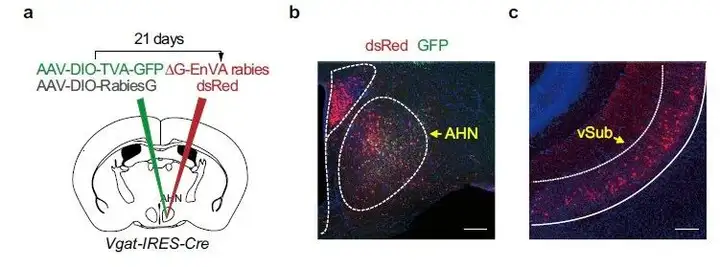
(AHN中起始细胞共表达AAV-DIO-TVA-GFP、AAV-DIO-RVG及RV-EnvA-△G-dsRed,黄色荧光;vSub中DsRed+神经元为上游输入神经元,红色荧光;Yan JJ, Ding XJ, He T, et al. Nat Commun. 2022.)
近期发表的客户文章:
[1]Hou Y, Zou G, Wang X, et al. Coordinated activity of a central pathway drives associative opioid analgesic tolerance. Sci Adv. 2023 Feb 10;9(6):eabo5627.
[2]Yan JJ, Ding XJ, He T, et al. A circuit from the ventral subiculum to anterior hypothalamic nucleus GABAergic neurons essential for anxiety-like behavioral avoidance. Nat Commun. 2022 Dec 3;13(1):7464
[3]Jia T, Wang YD, Chen J, et al. A nigro-subthalamo-parabrachial pathway modulates pain-like behaviors. Nat Commun. 2022 Dec 15;13(1):7756.
[4]Yu XD, Zhu Y, Sun QX, et al. Distinct serotonergic pathways to the amygdala underlie separate behavioral features of anxiety. Nat Neurosci. 2022 Dec;25(12):1651-1663.
[5]Zhong C, Wang L, Cao Y, et al. A neural circuit from the dorsal CA3 to the dorsomedial hypothalamus mediates balance between risk exploration and defense. Cell Rep. 2022 Nov 1;41(5):111570.[6]Li HY, Zhu MZ, Yuan XR, et al. A thalamic-primary auditory cortex circuit mediates resilience to stress Cell. 2023 Mar 30;186(7):1352-1368.e18.…
三、CVS株应用案例
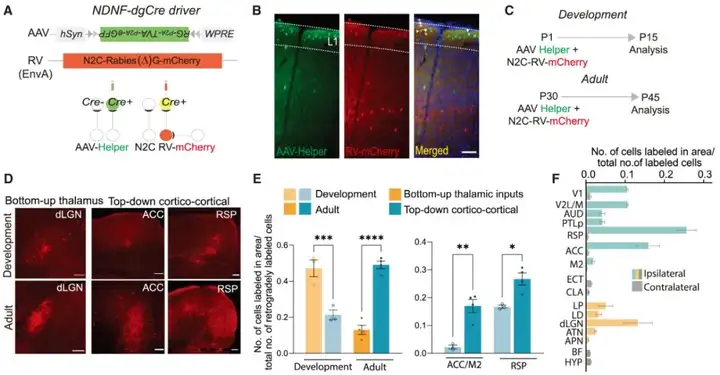
发育阶段皮层L1的INs输入神经元的改变:
为绘制皮层L1抑制性中间神经元(INs)的单突触神经传入连接图谱,研究人员使用NDNF-dgCre小鼠来标记L1的INs。通过Cre依赖性AAV辅助病毒联合基因修饰的CVS N2c株G糖蛋白缺失的狂犬病毒(N2c-RV),研究发育阶段和成年期投射到L1的INs的上游神经元。研究人员在小鼠出生后第一天(P1)注射AAV辅助病毒和狂犬病毒,并在两周后定量分析L1的INs的上游脑区,发现在发育过程中,L1的INs接收来自外侧膝状体背核(dLGN)的神经投射最为明显。而对于成年期的研究中,小鼠出生后第30天(P30)注射AAV辅助病毒和狂犬病毒,同样2周后分析,结果表明L1的INs接收来自dLGN的神经投射明显减弱,而接收来自前扣带皮层(ACC)、压后部皮层(RSP)和运动前区皮层(M2)的投射明显增加。
图4. 发育阶段皮层L1的INs输入神经元的转变
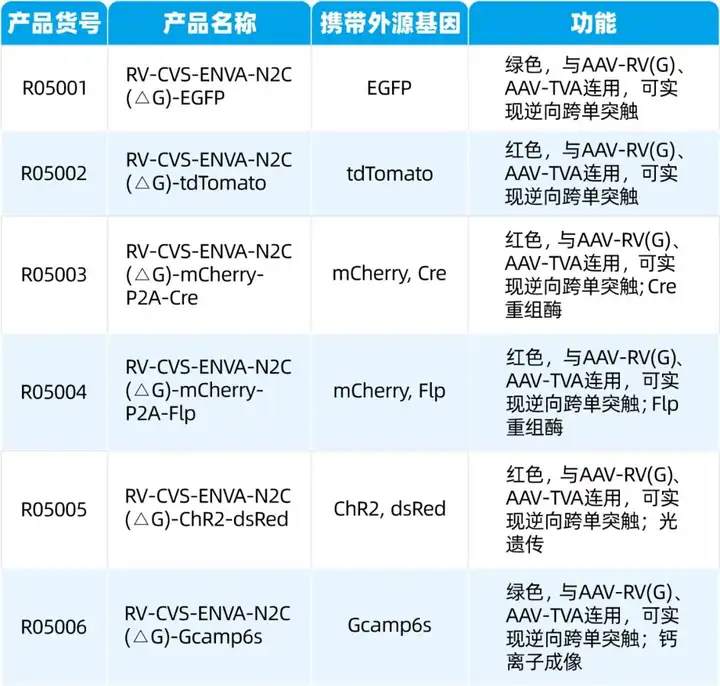
四、我司RV-CVS株病毒示踪测试示例——R05002
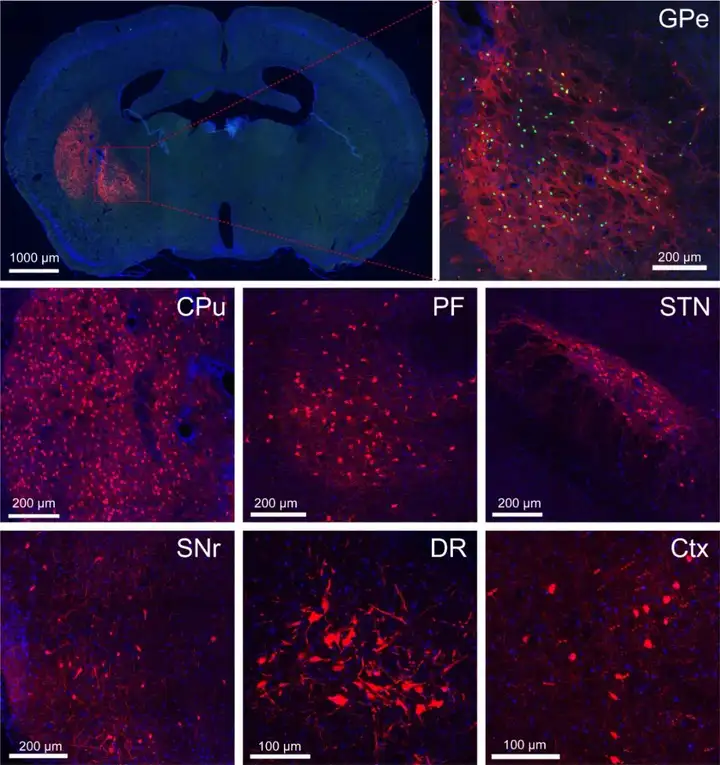
RV-CVS-ENVA-N2C(△G)-tdTomato标记效果图。注射位点为外侧苍白球GPe,对上游脑区进行示踪,逆标区域为尾状壳核CPu,丘脑束旁核PF,丘脑底核STN,黑质网状部SNr,背侧中缝核DR,大脑皮层Ctx。
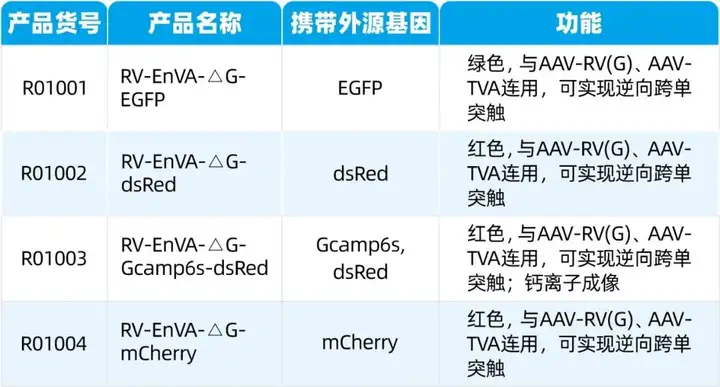
枢密科技可提供RV-CVS株及SAD-B19株病毒包装服务。RV-CVS株标记特征:更低的神经毒性,更轻微的神经损伤,更高效的标记效率;感染时间延长至一个月;可结合光遗传、钙成像、Cre、Flp等技术实现脑网络特异性功能研究及基因表达调控。
RV-SAD-B19株

详情欢迎扫码咨询
微信号:BrainVTA2020

市场:027-65023363 行政/人事:027-62439686 邮箱:marketing@brainvta.com
销售总监:张经理 18995532642 华东区:陈经理 18013970337 华南区:王经理 13100653525 华中/西区:杨经理 18186518905 华北区:张经理 18893721749
地址:中国武汉东湖高新区光谷七路128号中科开物产业园1号楼
Copyright © 武汉枢密脑科学技术有限公司. All RIGHTS RESERVED.
鄂ICP备2021009124号 DIGITAL BY VTHINK